Pourbaix-diagrammi
Pourbaix-diagrammi on sähkökemiassa käytetty, toiselta nimeltään E-pH-diagrammi tai potentiaali-pH-diagrammi. Ne antavat termodynaamista informaatiota metallien stabiileista faaseista vesipitoisessa sähkökemiallisessa järjestelmässä potentiaalin ja pH:n funktiona. Pourbaix-diagrammeista on nähtävissä, millä potentiaalilla ja pH:n arvolla metalli hapettuu (aktiivinen) ja millä alueilla se on korroosiolta suojattuna (immuuni tai passiivinen)[1]. Diagrammit on keksinyt Marcel Pourbaix (1904–1998).[2] Pourbaix-diagrammeja on saatavilla yli 70 eri metallille[3]. Pourbaix-diagrammeja hyödynnetään erityisesti korroosion ehkäisemisessä ja hallitsemisessa.
Diagrammin muodostaminen
Diagrammin muodostamisessa käytetään Nernstin yhtälöä. Se yhdistää elektrodin tasapainopotentiaalin sen standardipotentiaaliin Yleisessä reaktioyhtälössä
missä A ja B ovat lähtöaineita ja a ja b niiden kertoimet reaktioyhtälön mukaan, ja C ja D ovat tuotteita ja c ja d niiden kertoimet reaktioyhtälön mukaan. Tällöin Nernstin yhtälö voidaan esittää seuraavassa muodossa lämpötilan ollessa 25 °C [4][5]:
Yhtälössä R on yleinen kaasuvakio, T on lämpötila (K), F on Faradayn vakio ja n on reaktiossa siirtyvien elektronien lukumäärä. Tätä muotoa voidaan nyt hyödyntää Pourbaix-diagrammin muodostamisessa.
Pourbaix-diagrammin laskeminen ja tulkinta
Pourbaix-diagrammista voidaan tulkita eri alueita, joilla metalli on immuuni korroosiolle, passiivinen tai aktiivinen. Immuuneilla alueilla metallille ei tapahdu mitään. Passiivisilla alueilla metallin pintaan muodostuu passivoiva oksidi- tai suolakerros. Tunnetuin esimerkki tällaisesta passivoivasta kerroksesta on alumiinin pintaan muodostuva alumiinioksidikerros, joka estää alumiinia hapettumasta. Aktiivisilla alueilla muodostuu metalli-ioneja, jotka liukenevat veteen.[3]
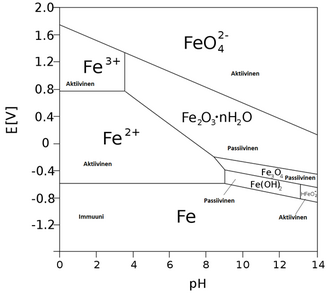
Esimerkkikuvassa (kuva 1) näkyy raudan Pourbaix-diagrammi. Y-akselilla esitetään elektrodipotentiaali E ja x-akselilla pH. Diagrammiin ovat merkittyinä immuunit, passiiviset ja aktiiviset alueet. Korroosiota tapahtuu aktiivisilla alueilla. Viivojen välisille alueille on merkittynä näissä olosuhteissa stabiilit yhdisteet. Esimerkiksi rauta(II,III)oksidi (mineraalina magnetiitti) Fe3O4 on raudan passiivinen oksidi. Passiivisilla alueilla metalli muodostaa kiinteän oksidikerroksen, joka estää sen alla olevaa puhdasta metallia hapettumiselta. Diagrammista huomataan, että mikäli elektrodipotentiaali siirretään negatiiviseen suuntaan, rautaelektrodi pakotetaan immuunille alueelle. Tätä prosessia kutsutaan myös katodiseksi suojaukseksi.[3]
Pourbaix-diagrammin laskeminen on suoraviivaista ja soveltuu tietokonelaskentaan. Toisaalta laskennassa on tehty tiettyjä oletuksia, jotka on pidettävä mielessä, kun diagrammia sovelletaan todellisiin tilanteisiin. Ensimmäisenä oletuksena on reaktioiden tasapainotila. Pourbaix-diagrammit ovat tasapainodiagrammeja, joten ne eivät anna tietoa reaktioiden kinetiikasta. Seuraavaksi on oletettu, että kaikki reaktiotuotteet ovat tunnettuja ja että kaikkien kiinteiden ja ionisten aineiden vapaa energia tunnetaan halutuissa olosuhteissa. Samoin oletetaan, että liuosten pH-arvot tunnetaan.[6] Diagrammi toimii vain puhtaille metalleille vesiliuoksessa standardiolosuhteissa. Jo hyvin pienet epäpuhtaudet saattavat hajottaa passivoivan kerroksen ja aiheuttaa näin korroosiota. Diagrammi ei ota huomioon lämpötilan vaikutusta reaktioihin.
Pourbaix-diagrammien laskennassa lämpötila (T) ja paine (p) oletetaan vakioiksi. Lämpötilan ja paineen arvoina yleisesti käytetään T = 298 K (25 °C) ja p = 1 atm (101 325 Pa). Pourbaix-diagrammi voidaan laskea myös muille lämpötiloille, mikäli termodynaamista dataa on saatavilla tai sitä voidaan arvioida. Diagrammia muodostettaessa ionimuodossa olevien komponenttien konsentraatio kiinteän ja liuenneen aineen rajapinnalla oletetaan matalaksi käyttämällä esimerkiksi konsentraation arvoa 10-6 M. Yleisesti diagrammin piirteet eivät suuresti muutu paineen kasvaessa, sillä lämpötilaan verrattuna termodynaamiset ominaisuudet eivät juurikaan riipu paineesta.[6]
Pourbaix-diagrammin viivat
Pourbaix-diagrammissa on havaittavissa kolmen tyyppisiä eri tasapainoja kuvaavia suoria viivoja[3]:
- Vaakasuorat viivat
- Pystysuorat viivat
- Kaltevat viivat
Vaakasuorat viivat kuvaavat reaktioita, jotka eivät riipu pH:n arvosta. Tällöin reaktiossa ei ole mukana H+- tai OH--ioneja.
Esimerkiksi systeemille, jossa on rautaioneja ja vettä, Fe2+:n ja Fe3+:n rajaviivalla reaktioyhtälö kirjoitetaan
Sijoittamalla reaktio Nernstin yhtälöön saadaan seuraava yhtälö
Molempien ionimuodossa olevien aineiden konsentraatiot ovat 10-6 M, jolloin Raja on siis vaakasuora viiva kohdassa
Pystysuorat viivat kuvaavat reaktioita, jotka eivät riipu potentiaalin arvosta, ainoastaan pH:n arvosta. Tällöin reaktiossa ei siirry elektroneja, eli n = 0.
Esimerkiksi rauta-vesi-systeemissä Fe3+:n ja Fe2O3:n välisellä rajaviivalla reaktioyhtälö on
ja jolle Gibbsin energia . Gibbsin energialle on seuraava yhtälö
mikä saadaan logaritmien laskusääntöjä soveltamalla muotoon
Pourbaix-diagrammin pystysuora viiva on täten kohdassa pH = 1,76.
Kaltevat viivat kuvaavat reaktioita, jotka riippuvat sekä pH:n että potentiaalin arvosta. Tällöin reaktiossa on mukana sekä elektroneja että H+-ioneja ja potentiaali on pH:n funktiona.
Rauta-vesi-esimerkissä Fe2+:n ja Fe2O3:n välisellä rajalla reaktioyhtälö kirjoitetaan
ja jolle Nernstin yhtälö saadaan siis muotoon
Kiinteiden aineiden ja veden aktiivisuudet ovat yksi ja supistuvat pois ja rauta(II)ionin konsentraatio on jolloin saadaan
Kun potentiaali on alle –0,62 V, verrattuna standardivetyelektrodiin (SHE), rauta on termodynaamisesti stabiili ja katodisesti suojattu korroosiolta. Kun potentiaali on yli –0,62 V ja pH on alle 9, rauta hapettuu muodostaen Fe2+- ja Fe3+-ioneja. Kuvan 1 kuvaajasta nähdään, että Fe2+ on stabiilimpi alemmilla potentiaaleilla kuin Fe3+. Yksi korroosioalue havaitaan raudan diagrammista, kun potentiaali on alle –0,8 V ja pH yli 13. Tällöin rauta hapettuu seuraavalla reaktiolla [7]:
Passiivisilla alueilla Fe2O3:n ja Fe3O4 muodostumisen johdosta metalli on anodisesti suojattu. Oksidien muodostuminen johtaa pinnan passivoitumiseen ja suojaa metallia korroosiolta [7].
Veden stabiilisuus
Diagrammin piirtämisessä on myös otettava huomioon veden stabiilisuus. Vesi ei itsessään pysy stabiilina kaikissa olosuhteissa, vaan se hajoaa joko vedyksi tai hapeksi riippuen systeemin pH:sta ja potentiaalista.[3] Ilmiö on otettava huomioon, sillä korroosio tapahtuu hyvin usein vesiliuoksissa.

Happamissa olosuhteissa vesiliuoksessa tapahtuu seuraava reaktio potentiaalin laskiessa:
Tällöin muodostuu vetykaasua eikä vesi ole enää stabiili yhdiste. Samoin emäksisissä olosuhteissa tapahtuu seuraava reaktio:
Tällöin vesi hajoaa tuottaen vetykaasua. Edellä mainituille yhtälöille voidaan muodostaa seuraavanlainen Nernstin yhtälö (25 °C):
joka voidaan piirtää Pourbaix-diagrammeihin alempana katkoviivana (kuten kuvassa 2). Samoin potentiaalia kasvattaessa vesi hajoaa seuraavalla tavalla:
Tällöin syntyy happikaasua. Pourbaix-diagrammiin tämä ilmiö voidaan piirtää seuraavan yhtälön avulla:
Tämä suora näkyy esimerkiksi kuvassa 2 ylempänä katkoviivana. Näiden kahden lasketun katkoviivan välisellä alueella vesi on siis termodynaamisesti stabiilia, sen yläpuolella happikaasu on stabiilimpaa ja alapuolella puolestaan vetykaasu stabiilimpaa. [3]